【新药界】海外安全性数据不及预期,罗沙司他
【作者】:网站采编
【关键词】:
【摘要】[新药界,是界面新闻新近推出的新药点评栏目,立足商业视角,解读上市新药。] 记者 | 谢欣 编辑 | 任悠悠 1 在美股的生物医药板块上时不时能看到以下现象:当一家药企一项重磅产品
[新药界,是界面新闻新近推出的新药点评栏目,立足商业视角,解读上市新药。]
记者 | 谢欣
编辑 | 任悠悠
1
在美股的生物医药板块上时不时能看到以下现象:当一家药企一项重磅产品的临床试验“揭盲”后,伴随着结果的悲或喜,这家公司的股价也会大跌或大涨,较近期的如某知名药企的阿尔茨海默症药物研发失败后股价大跌了30%。
今年5月9日,这一幕再次出现。
当日,珐博进(FibroGen)和阿斯利康(AstraZeneca)联合公布了其慢性肾脏病性贫血首创疗法Roxadustat(罗沙司他)的安全性结果,随后珐博进股价急剧跳水,跌幅超过26%,并在此后两个交易日继续下跌至年内低点。
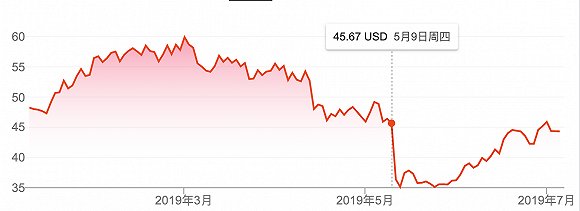
FibroGen今年股价表现
作为首款全球研发,中国率先孵化并已获批上市的国产I类原创新药,罗沙司他的表现自然牵动着大众的神经。
此次股价大跌的主要原因是在本次公布的罗沙司他7项临床试验安全性数据中,美国食品药品监督管理局(FDA)所认可的主要不良心血管事件(MACE)仅获得“没有临床意义上的差异“的结论。
也就是说,与现有的常规治疗手段促红细胞生成素(rHuEPO)相比,罗沙司他在FDA对心血管副作用的认定标准之下并未体现出优势。
华尔街的分析师们认为,这将为罗沙司他在美国的上市及后续市场情况增添许多不确定性,未来可能需要企业、监管部门、医院与市场各方进行再评估。
肾性贫血三十年以来的首款新药
时间回拨到2018年12月,当国家药品监督管理局(NMPA)以优先审评审批通过罗沙司他(国内商品名:爱瑞卓)用于治疗正在接受透析治疗的患者因慢性肾脏病(CKD)引起的贫血时,该药品还尚未在其他任何国家上市。作为国内肾性贫血领域30年来首款新药,罗沙司他在国内临床应用与新药上市的象征性上兼具标志性意义。
此前三十年时间里,肾性贫血领域并未有真正意义上的新药物出现,复旦大学肾脏研究所所长,复旦大学华山医院终身教授林善锬教授此前曾表示,该药品有望让中国肾脏科领域“彻底翻身”。
作为全球首个低氧诱导因子脯氨酰羟化酶抑制剂(HIF-PHI),罗沙司他的作用机理是通过抑制低氧诱导因子(HIF)的泛素化降解,促进内源性促红细胞生成素生成,改善铁的吸收,降低铁调素。在慢性肾脏病患者的多个亚群中,罗沙司他能够维持红细胞生成素水平处于或接近正常生理范围,进而增加红细胞数量,同时不受炎症状态影响,也可避免静脉补铁。
珐博进是罗沙司他的研发发起人,其与阿斯利康达成合作在美国、中国及其他市场共同开展罗沙司他用于慢性肾脏病患者贫血治疗的开发及上市推广工作。阿斯利康和珐博进合作在中国开展罗沙司他的研发项目和商业化活动。
罗沙司他在国内共有20mg与50mg两种规格,根据药品说明书,患者根据体重选择起始剂量:透析患者为每次100mg ( 45-60kg )或120mg( ≥60kg),通过口服给药每周三次(TIW)。研究显示进食不会显著影响罗沙司他的暴露量,因此可空腹服用或与食物同服。对于正在接受血液透析或腹膜透析的患者,可在透析治疗前后的任何时间服用罗沙司他。
今年4月,在药品尚未实现商业上市前,罗沙司他就已先行启动赠药项目,计划将覆盖3万名接受透析的肾性贫血患者。
有关罗沙司他的临床试验一直未停止。
目前,仅针对肾性贫血这一适应症罗沙司他在全球就开展了16项III期临床试验,包括8项在美国与欧盟进行(7项已完成)、2项在中国(已完成)、6项在日本进行(4项已完成),而上述已完成的临床试验都达到了主要疗效终点。
阿斯利康对界面新闻介绍称,本次罗沙司他全球III期研究项目由阿斯利康、珐博进和安斯泰来共同实施,样本来自50多个国家,总量高达9000多名患者。本次试验为心血管安全性评估,是罗沙司总体收益-风险评估的一部分。
在所有患者中,1500名初始非稳定期透析患者在使用了罗沙司他和阿法依泊汀之后,结果显示前者的有效性比后者更显著。4300多名非透析患者的试验效果显示,罗沙司他与安慰剂相比更具有效性,其可通过减缓肾小球滤过率(eGFR)降低的速度延缓肾功能下降。
这本是令人振奋的消息,但5月9日在罗沙司他临床试验安全性数据公布后,FDA后续对罗沙司他的态度是否会波及到中国市场,不禁令人心中充满疑问。
临床安全性数据上的“争议”
根据5月9日的安全性数据,罗沙司他在美国与欧美已完成7项临床试验。这7项试验中,罗沙司他在欧盟药监局(EMA)认可的主要不良心血管事件、心衰和不稳定性心绞痛(MACE+)上达到“非劣效性“(95% CI),在FDA认可的主要不良心血管事件(MACE)得到“没有临床意义上的差异“的结论。
文章来源:《中国药物经济学》 网址: http://www.zgywjjx.cn/zonghexinwen/2020/0924/534.html
中国药物经济学投稿 | 中国药物经济学编辑部| 中国药物经济学版面费 | 中国药物经济学论文发表 | 中国药物经济学最新目录
Copyright © 2018 《中国药物经济学》杂志社 版权所有
投稿电话: 投稿邮箱:
